- مؤلف Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:32.
- آخر تعديل 2025-01-23 10:59.
الفرق الرئيسي - الميثان مقابل الإيثان
الميثان والإيثان هما أصغر أعضاء عائلة الألكان. الصيغ الجزيئية لهذين المركبين العضويين هي CH4و C2H6على التوالي. الفرق الرئيسي بين الميثان والإيثان هو التركيب الكيميائي ؛ يمكن اعتبار جزيء الإيثان كمجموعتين ميثيل متصلتين كثنائي لمجموعات الميثيل. تنشأ الاختلافات الكيميائية والفيزيائية الأخرى بشكل أساسي بسبب هذا الاختلاف الهيكلي.
ما هو الميثان؟
الميثان هو أصغر عضو في عائلة الألكان بالصيغة الكيميائية CH4(ترتبط أربع ذرات هيدروجين بذرة كربون واحدة).يعتبر المكون الرئيسي للغاز الطبيعي. الميثان غاز عديم اللون والرائحة والمذاق. يُعرف أيضًا باسم الكاربين ، وغاز المستنقعات ، والغاز الطبيعي ، ورابع هيدريد الكربون ، وكربيد الهيدروجين. يمكن إشعالها بسهولة ، وبخارها أخف من الهواء.
يوجد الميثان بشكل طبيعي تحت الأرض وتحت قاع البحر. يعتبر غاز الميثان الموجود في الغلاف الجوي من غازات الدفيئة. يتحلل الميثان إلى CH3- مع وجود الماء في الغلاف الجوي.
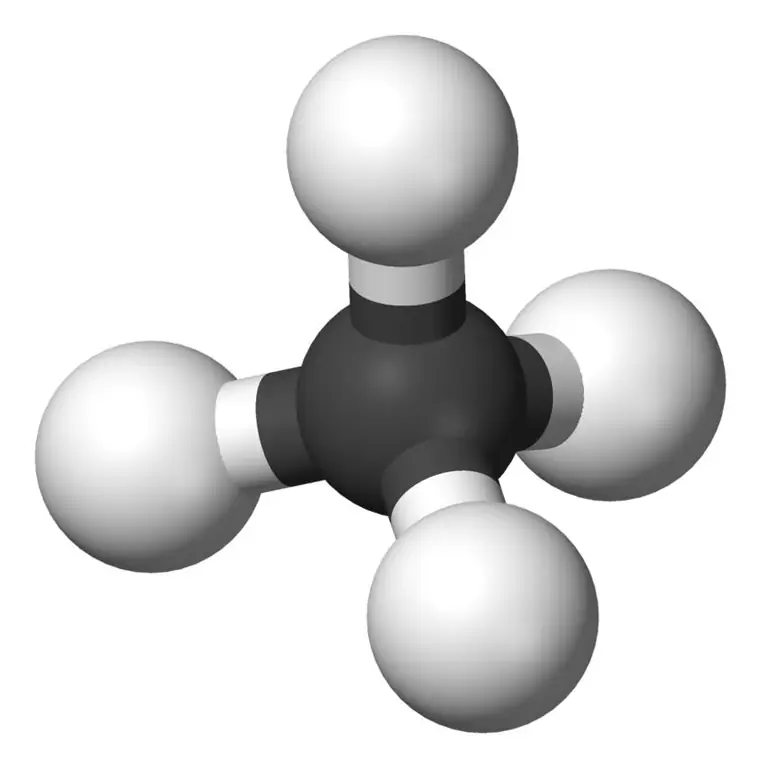
ما هو الإيثان؟
الإيثان مركب غازي عديم اللون والرائحة عند درجة الحرارة والضغط القياسيين. صيغته الجزيئية ووزنه الجزيئي هما C2H6و 30.07 جم · مول−1على التوالي. وهو معزول عن الغاز الطبيعي كمنتج ثانوي من عملية تكرير البترول.الإيثان مهم جدا في إنتاج الإيثيلين
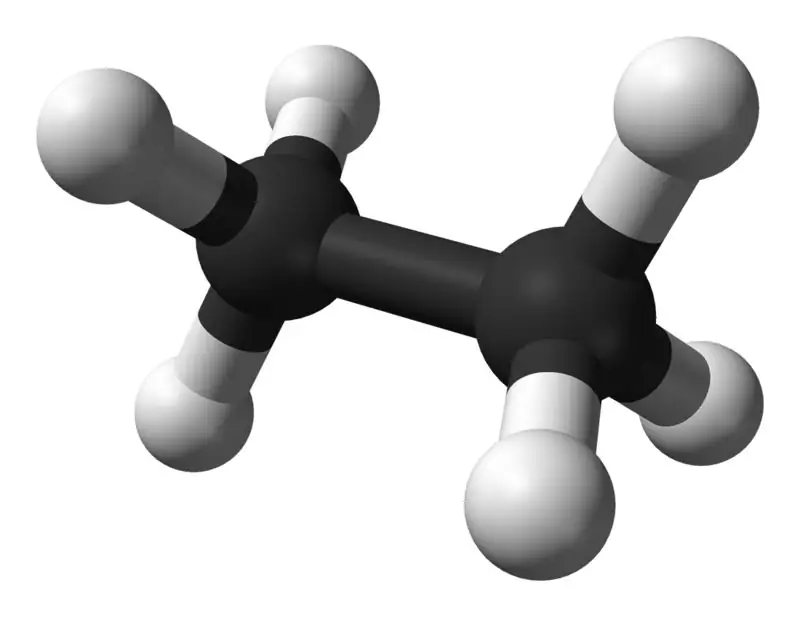
ما الفرق بين الميثان والإيثان؟
خصائص الميثان والإيثان
الهيكل:
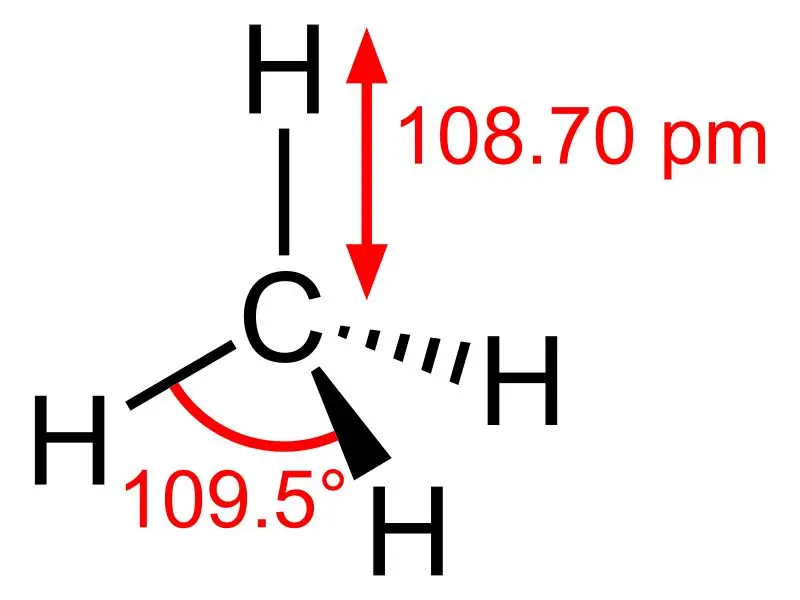
الميثان: الصيغة الجزيئية للميثان هي CH4 ،وهي مثال على جزيء رباعي السطوح مع أربعة روابط C-H مكافئة (روابط سيجما). زاوية الرابطة بين ذرات H-C-H هي 109.50وجميع روابط C-H متكافئة ، وهي تساوي 108.70 مساءً.
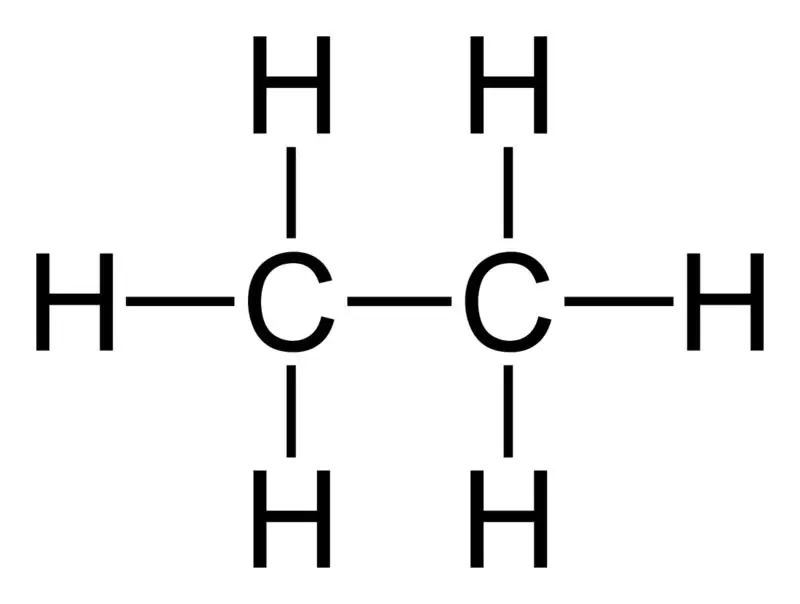
الإيثان: الصيغة الجزيئية للإيثان هي C2H6 ،وهي هيدروكربون مشبع لأنها لا تحتوي على روابط متعددة
الخصائص الكيميائية:
الميثان:
الاستقرار: الميثان جزيء مستقر كيميائيًا جدًا ولا يتفاعل مع KMnO4، K2Cr2O7، H2SO4أو HNO3في ظل الظروف العادية.
الاحتراق: في وجود الهواء الزائد أو الأكسجين ، يحترق الميثان بلهب أزرق شاحب غير مضيء ينتج عنه ثاني أكسيد الكربون والماء. إنه تفاعل طارد للحرارة للغاية ؛ لذلك ، يتم استخدامه كوقود ممتاز. في حالة وجود هواء أو أكسجين غير كافٍ ، فإنه يحترق جزئيًا في غاز أول أكسيد الكربون (CO).
تفاعلات الاستبدال: يُظهر الميثان تفاعلات الاستبدال مع الهالوجينات. في هذه التفاعلات ، يتم استبدال ذرة أو أكثر من ذرات الهيدروجين بعدد متساوٍ من ذرات الهالوجين وتسمى "الهالوجين".يتفاعل مع الكلور (Cl) والبروم (Br) في وجود ضوء الشمس.
التفاعل مع البخار: عندما يتم تمرير خليط من الميثان والبخار عبر نيكل ساخن (1000 كلفن) مدعوم على سطح الألومينا ، يمكن أن ينتج الهيدروجين.
الانحلال الحراري: عندما يتم تسخين الميثان إلى حوالي 1300 كلفن ، يتحلل إلى أسود الكربون والهيدروجين.
إيثان:
التفاعلات: يتفاعل غاز الإيثان (CH3CH3) مع بخار البروم في وجود الضوء لتشكيل البروموثان ، (CH3CH2Br) وبروميد الهيدروجين (HBr). إنه رد فعل إحلال. يتم استبدال ذرة الهيدروجين في الإيثان بواسطة ذرة البروم.
CH3CH3+ Br2à CH3CH2Br + HBr
الاحتراق: ينتج عن الاحتراق الكامل للإيثان 1559.7 كيلوجول / مول (51.9 كيلوجول / غرام) من الحرارة وثاني أكسيد الكربون والماء.
2 C2H6+ 7 O2→ 4 CO2+ 6 H2O + 3120 kJ
يمكن أن يحدث أيضًا بدون زيادة الأكسجين ، مما ينتج عنه مزيج من الكربون غير المتبلور وأول أكسيد الكربون.
2 C2H6+ 3 O2→ 4 C + 6 H2O + طاقة
2 C2H6+ 5 O2→ 4 CO + 6 H2O + طاقة
2 C2H6+ 4 O2→ 2 C + 2 CO + 6 H2O + طاقة وما إلى ذلك
تعريفات:
تفاعلات الاستبدال: تفاعل الاستبدال هو تفاعل كيميائي يتضمن إزاحة مجموعة وظيفية واحدة في مركب كيميائي واستبدالها بمجموعة وظيفية أخرى.
الاستخدامات:
الميثان: يستخدم الميثان في العديد من العمليات الكيميائية الصناعية (كوقود ، غاز طبيعي ، غاز طبيعي مسال) ويتم نقله كسوائل مبردة.
الإيثان: يستخدم الإيثان كوقود للمحركات وكمبرد لنظام درجة حرارة منخفضة للغاية. يتم شحنها في اسطوانات فولاذية كغاز مسال تحت ضغط البخار الخاص بها.






